此活动已结束,注册已经关闭。在DIA中国中查看更多活动
活动详情
临床研究是提高健康医疗水平、加强民生保障、增强医药创新最为关键的环节。2017年下半年国家各部委出台了一系列政策,进一步鼓励创新,推动临床研究能力提升。特别是2017年10月8日,中共中央办公厅和国务院办公厅发布《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,在改革临床试验管理、加快上市审评审批、促进药品创新等方面,提出了若干项重大改革举措。
我国的临床研究总体水平在全球12个主要医药创新国家中排名第9位。对临床研究的需求与临床研究资源之间存在严重不平衡。2017年1-10月获得临床批件的化药1.1类和生物制品1类的数量是2014年的3倍,而中国GCP认证的机构数在这一阶段却没有显著变化。近年来,随着精准医学、肿瘤免疫等新兴疗法的不断涌现,对研究人员的要求也更为提高。
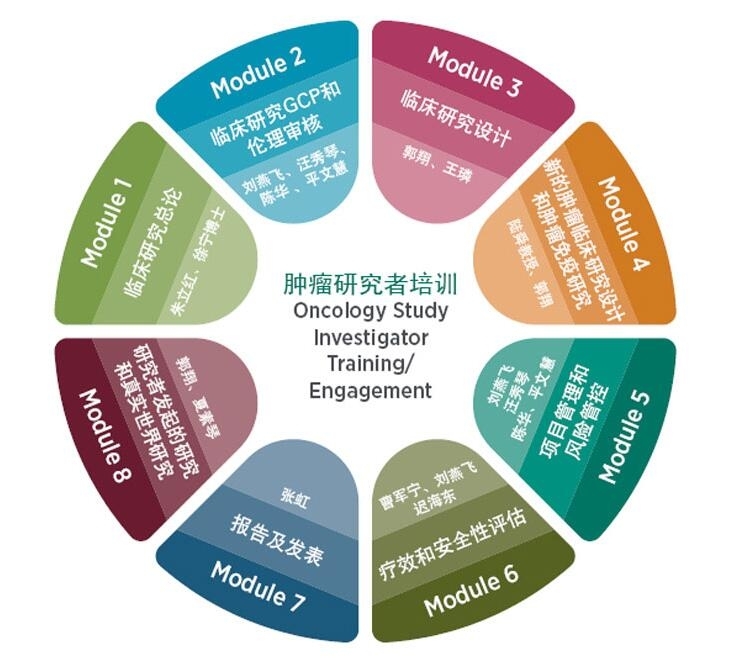
本次旗舰课程将通过2天的分享,利用临床、工业界等多方资源,通过聚焦肿瘤药物研发概述、肿瘤临床研究设计、疗效和安全性评估、风险管控以及真实世界研究等5大方面,为参与肿瘤临床试验的医生、护士、医药管理者以及临床研究相关专业人员提供培训,切实提高临床研究操作的实际能力,以确保高质量临床研究。
学习目标
- 了解研究者在临床试验中的职责
- 了解临床试验ICH GCP及药物研发的概况
- 学习并掌握肿瘤药物临床试验及药物审批过程中的关键考量点及特殊的设计方法
- 学习在临床研究基地所需掌握的主要项目管理技能
- 掌握风险管理及质量把控的主要考量
- 学习医学写作和发表的技能
- 深入探讨研究者发起的研究和真实世界研究
学习模块
培训地址
上海市徐汇区枫林路388号枫林国际中心,昆泰企业管理(上海)有限公司A座5楼
社区
联系该活动与会者中的30个人
查看社区资料并将与会者加入您的收藏夹
票务信息
- 企业 - 会员
- 人民币 3,500
- 企业 - 非会员
- 人民币 4,500
